DNAシーケンシング技術や情報科学の進歩により、これまで確定診断できなかった症例を診断できるケースが増え、遺伝子情報を踏まえた治療法の選択も行われています。本講演では、1994年に世界初のDNA専門研究機関として設立され、希少難病の遺伝学的検査を精力的に行ってきた、かずさDNA研究所の小原収先生をお招きし、希少難病の遺伝学的検査の現状と今後の課題について解説していただきました。特に検体検査の活用のために、ぜひご理解いただきたいポイントをご紹介していただきました。
希少難病の診断とシーケンシングによる遺伝学的検査
遺伝学的検査とは遺伝学的な素因を調べるための検査の総称で、その種類には、DNAやRNAの塩基配列を調べる分子遺伝学的検査や、遺伝生化学的検査、染色体検査などがあります。希少難病の診断には、DNAの塩基配列をヒトリファレンスゲノムと疾患発病者で比較し、塩基配列の違いを検出するDNAシーケンシングがしばしば用いられます。本講演では、このDNAシーケンシングに依拠した検査について解説します。
希少難病の遺伝学的検査の特徴と課題
希少難病では、遺伝子の変異(遺伝子型)と疾患の症状(表現型)をつなぐ情報が不足しています。また遺伝学的検査の体制にも2つの課題があります。
1つ目は、検査のコストです。希少難病は疾患の原因遺伝子の数がさまざまで、1種類の場合もあれば数百種類に及ぶこともあります。また疾患の種類も多いため、検査の対象となる遺伝子が多数あります。一方で、単一症候群あたりの検査数は、年間、数件~数百件と極めて少ないため、検体あたりの検査コストがかさみます。保険収載されている検査は多いものの、病院から委託されるコストの上限があらかじめ決まっているので、その範囲内で検査を行わなければなりません。
2つ目は検査に要する時間です。例えば骨髄移植を待っている患者さんの場合など、なるべく早く検査結果を示すことが求められます。
次世代シーケンサーの登場による遺伝学的検査のコストダウンと迅速化
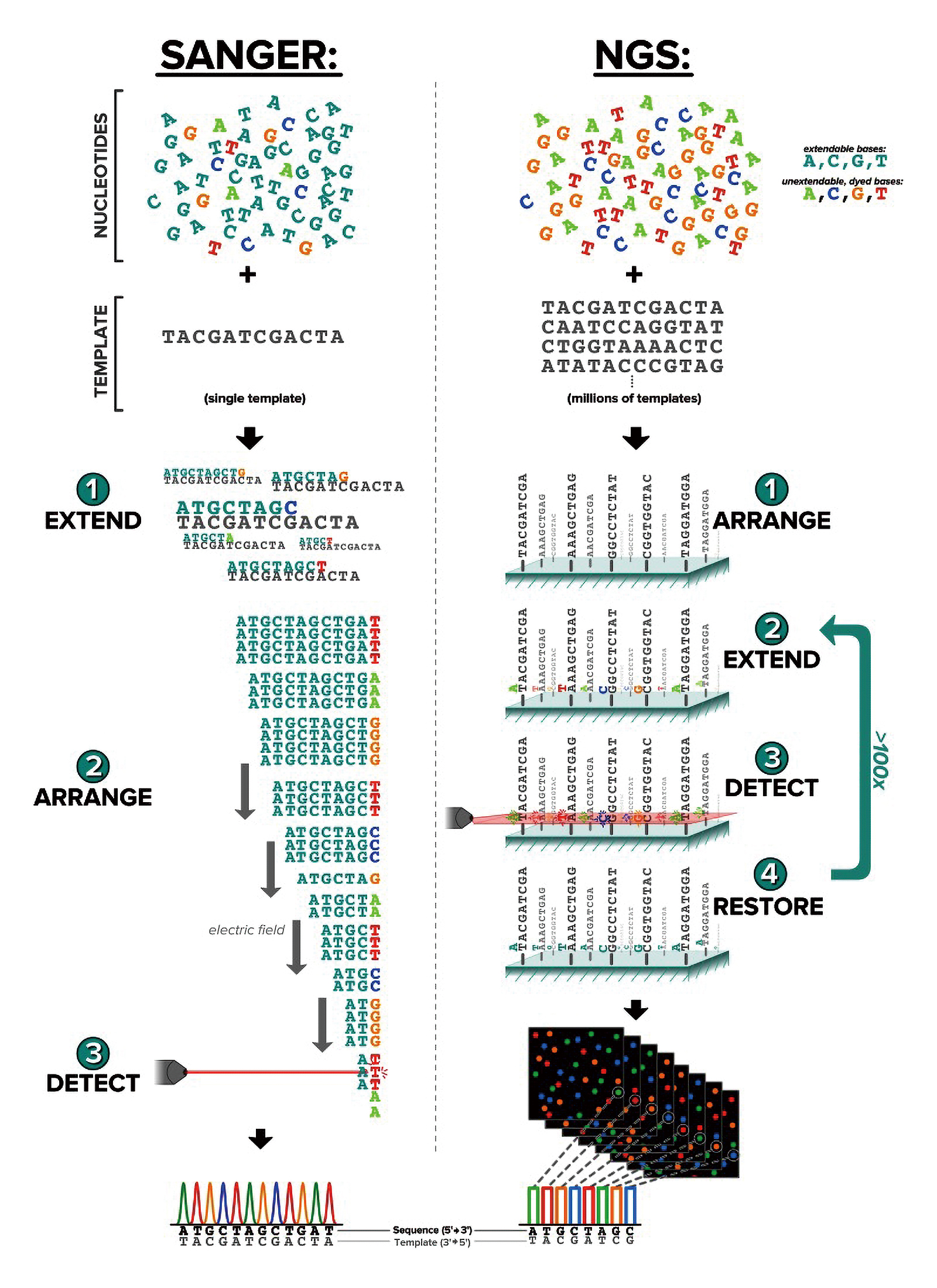
遺伝学的検査のコストと時間の問題を解決する上で欠かせないのがシーケンシング技術の向上です。従来のシーケンシングはサンガーシーケンスを用いて行われていました(図1左)。サンガーシーケンスでは、同一の配列を有する多くの分子か集団を調製する必要があり、また一度にシーケンシングできるのは1回のシーケンス作業で1つだけでした(赤枠)。次世代シーケンス(NGS: Next Generation Sequencing、図1右)では、1分子ずつのシーケンシングが可能であり、また、一度に何百万ものフラグメントの塩基配列を並行して解析することができます(赤枠)。この結果、NGSではサンガーシーケンスに比べて大量かつ高速にデータを解析することが可能になりました。イルミナ社の次世代シーケンサーの場合、1回あたりのランで最大6テラベースを解析でき、1ギガベースあたりのコストも1,000円以下にまで抑えられるものもあります。ヒトの全ゲノムは約3ギガベースですので、言い換えれば、その3分の1程度の塩基配列を1,000円で解析できる時代が到来したことになります。
今日では、ヒト全ゲノム解析をはじめ、ゲノムのエクソン領域のみを濃縮して解析するエクソーム解析や、疾患の原因遺伝子を一度にまとめて解析する遺伝子パネル検査にもNGSが活用されています。
図1. サンガーシーケンスと次世代シーケンス (NGS)
遺伝学的検査の流れ
遺伝学的検査の選択から診断までの流れは次のとおりです(図2)。
● 疑われる疾患を絞り込む
患者の臨床情報から疑われる疾患をPubCaseFinderやGeneReviewsで絞り込み、どのような検査が必要かを考えます。ただし、これらのサイトは臨床利用目的ではないので、参考情報として利用するようにしてください。
● 検査を行っている施設を探す
疾患名に基づき、検査が行われている施設を探します。2018年の医療法改正により、臨床用の検体検査は衛生検査所として登録された施設または病院の施設の中でのみ行われるようになりました。また一部の検査には保険が適用されています。保険収載されている検査は「難病領域における検体検査の精度管理体制の整備に資する研究班(終了)」のサイトで調べることができます。
● 検査の内容を確認する
各施設のHPで、検査内容を確認します。かずさ遺伝子検査室で行っている検査については、遺伝子名または検査項目名で検査の内容を調べることができます。
● 検査を依頼する
各施設に検査内容や契約方法などについて問い合わせて、検査を依頼します。
● 検査結果を受領する
かずさ遺伝子検査室では検査報告書に、検査方法、報告対象となるバリアント(変異)の閾値、解析遺伝子名、検出されたバリアントなどを記載しています。また、遺伝学的検査だけで診断を行うのは難しいため、参考となるデータベースや臨床遺伝専門医のコメントを検査報告書に記載し、主治医が臨床医同士の立場での相談や診断支援を受けられるようにサポートしています。
● バリアントと疾患の関係性を調べる
バリアントと疾患の関係性やバリアントの病原性*を調べるには、各種データベース(例:The Human Gene Mutation Database、ClinVar、TOGOVAR(日本人データに特化したデータベース))を活用します。また、疾患の診断における遺伝学的検査の信頼度を、遺伝子ごとに限定的(Limited)、中程度(Moderate)、高程度(Strong)、決定的(Definitive)、不明(Disputed)に分類しているサイト(ClinGenのGene-Disease Validity)も参考になります。なお、正確な診断を行うためには、遺伝学的検査の結果だけでなく、家族歴や患者本人の臨床情報を統合的に解釈することが重要です。
図2. 遺伝学的検査の選択から診断までの流れ
| 1 | 疑われる疾患を絞り込む |
| ↓ | PubCaseFinder* GeneReviews*(日本語版) *臨床利用目的ではないサイトのため、あくまで参考情報としてご利用ください。 |
| 2 | 検査を行っている施設を探す |
| ↓ | 難病領域における検体検査の精度管理体制の整備に資する研究班(終了) 保険収載されている遺伝学的検査(D006-4) |
| 3 | 検査の内容を確認する |
| ↓ | 【例】かずさ遺伝子検査室・遺伝学的検査リスト |
| 4 | 検査を依頼する |
| ↓ | |
| 5 | 検査結果を受領する |
| ↓ | |
| 6 | バリアントと疾患の関係性を調べる |
| ↓ | The Human Gene Mutation Database(有償) ClinVar TOGOVAR(日本人データ) ClinGenのGene-Disease Validity |
| 7 | 診断する |
| ※各URLは2022年7月時点のものです。 |
バリアントの病原性*:一般的には、American College of Medical Genetics (ACMG) およびAssociation for Molecular Pathology(AMP)が2015年に共同で発表したガイドラインに従って、バリアントを複数の基準で評価し、総合的な病原性を、病原性あり(Pathogenic)、病原性を持つ可能性がある(Likely Pathogenic)、重要性不明(Uncertain significance)、良性である可能性が高い(Likely benign)、良性(Benign)の5段階に分類します。この基準もアップデートされていますので、最新版をウェブなどで確認いただくことが重要です。
今後の課題
現在、AIを活用した結果判断の迅速化やNGS検査のフローを明示したガイドラインの整備が検討されています。その他にも、以下の2点が今後の重要な課題として挙げられます。
1つ目は、希少難病に関しては、原因遺伝子において病原性との関連が特定されているバリアントの数が、未だに極めて少ないことです。臨床研究を推進し、原因遺伝子に関するデータを蓄積することが求められています。
2つ目は、検査技術のさらなる革新です。ゲノムDNAは疾患の原因にはなるものの、現時点での患者の健康状態を反映しているとは限りません。生体内のタンパク質、RNA、代謝物の解析をNGSと組み合わせたマルチオミクスアプローチにより、より精度の高い診断が可能となります。特に近年、タンパク質を調べるプロテオーム解析の技術が向上しており、今後は臨床情報を基に、まずはタンパク質を調べてからゲノムDNAを調べることで、より確実な診断が、低コストかつ迅速に実現できる時代がやってくるかもしれません。