エクソームシーケンス
エクソームシーケンスとは
全エクソームシーケンスは、ゲノムのタンパク質コード領域の配列を決定する次世代シーケンサー(NGS)法として広く用いられている手法です。ヒトのエクソームは、ゲノムの2%未満にすぎませんが、既知の疾患関連のバリアントの約85%を含んでいるため1、この手法は全ゲノムシーケンスに対する費用対効果の高い代替手法となります。
エクソーム濃縮を使用したエクソームシーケンスは、集団遺伝学、遺伝性疾患、がん研究を含む幅広い用途全体にわたってコーディングバリアントを効率的に同定できます。
エクソームシーケンスの利点
- 幅広いアプリケーションにわたってバリアントを同定
- コード領域の包括的なカバレッジを達成する
- 全ゲノムシーケンスに代わる費用対効果の高い手法を提供する(全ヒトゲノムあたり約90 Gbに対してエクソームあたり4~5 Gbのシーケンス)
- 全ゲノムアプローチよりも小さく管理しやすいデータセットを生成して、より速く簡単なデータ解析を実現する
全エクソームと全ゲノムシーケンスの比較
両方のアプローチのメリットを探り、どの手法が研究に最適であるかを理解してください。
コード領域の効率的な解析
エクソームシーケンスは、全ゲノムシーケンスが現実的でないか必要でない場合に費用対効果の高いアプローチです。ゲノムのコーディング領域のみをシーケンスすることで、表現型に影響する可能性が最も高い遺伝子にリソースを集中でき、利用しやすいターンアラウンドタイムと価格の組み合わせを提供します。
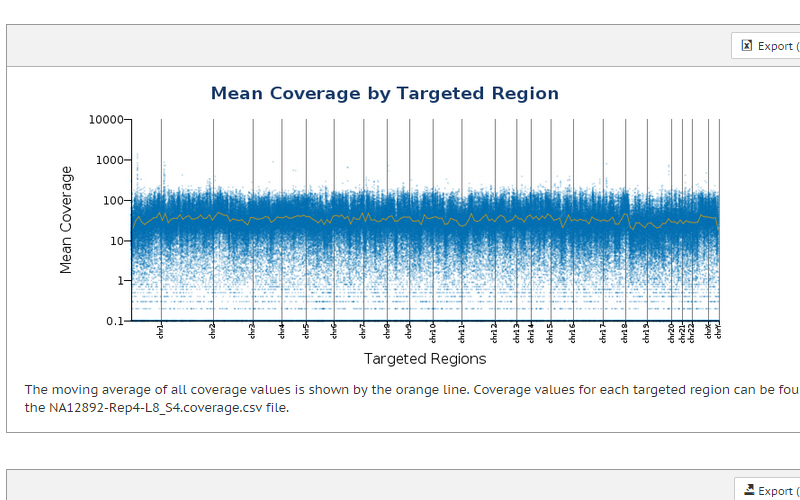
エクソームシーケンスでは、コーディングエクソンにおけるバリアントを検出し、さらに非翻訳領域(UTR)やマイクロRNAなど標的コンテンツを拡張して、遺伝子制御をより包括的に見ることができます。DNAライブラリーは、わずか1日で用意でき、エクソームあたり4~5 Gbのシーケンスしか必要ありません。


注目のエクソームシーケンス研究

何千ものサンプルをシーケンスして新規のバリアントに対する洞察を得る
Regeneron Genetics Centerの科学者が、臨床研究のデータセットに対してエクソームシーケンス解析を実施し、遺伝的関連を同定します。
記事を読む
エクソームとRNA-Seqを使用した希少な遺伝性疾患の研究
全エクソームシーケンスとRNAシーケンスは、希少な疾患に関連する変異とパスウェイを解明する上で有益であることが実証されています。
記事を読む
腫瘍エクソームが、がん生物学に対する新しい知見を明らかに
研究者が腫瘍生検サンプルからがんWESを実施し、腫瘍の発症や進行についての理解を深め、バイオマーカーを同定し、治療的介入に対する反応を予測する方法をご覧ください。
記事を読む推奨される全エクソームシーケンスワークフロー
イルミナは、エクソーム濃縮やライブラリー調製から、シーケンス、データ解析、生物学の解釈に至るまでのプロセス全体を簡素化する全エクソームシーケンスワークフローを提供しています。
ライブラリー調製
Illumina DNA Prep with Exome 2.5 Enrichment
幅広いアプリケーションに対応する、高速で、統合された全エクソーム濃縮およびシーケンスライブラリー調製のワークフロー。
Illumina Custom Enrichment Panel v2
目的のターゲット向けに設計されたカスタムスパイクインパネルでエクソームカバレッジを拡大または強化します。
Illumina Cell-Free DNA Prep with Enrichment
セルフリーDNAサンプルから少量の変異を検出する高感度ライブラリー調製ソリューションです。
Illumina FFPE DNA Prep with Exome 2.5 Enrichment
FFPE(ホルマリン固定パラフィン包埋)サンプルから低頻度バリアントを検出するための、高感度で包括的な全エクソームシーケンスソリューションです。
シーケンシング
NovaSeq X Series
フローセルあたり最大16 Tbの出力と260億のシングルリードを特徴とする、超ハイスループットプロジェクト向けの最も強力なシーケンサーです。
NovaSeq 6000システム
スケーラブルなスループットと柔軟性により、ほぼすべてのゲノム、シーケンス手法、プロジェクト規模に対応します。
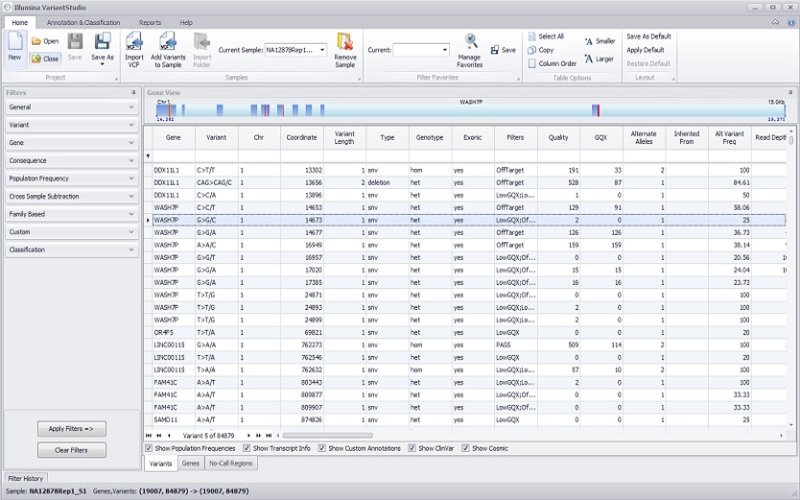
エクソームシーケンスデータ解析
イルミナのDRAGENの二次解析は、エクソームやゲノム、トランスクリプトーム、メチローム研究など、幅広いアプリケーションに対応したNGSデータ解析に伴う重要な課題に対応するために開発されました。このソフトウェアスイートは、NGSデータを迅速に処理し、三次解析によって洞察を導き出します。使用可能なツールは、非常に高い精度の包括的かつ効率的なソリューションで構成され、あらゆる規模や分野のラボがゲノムデータを用いてより多くのことを行うことが可能です。
DRAGENの詳細はこちらCOPD研究のための効率的なエクソームとマルチオミクスデータ解析
慢性閉塞性肺疾患(COPD)研究プロジェクトにおいて、エクソームシーケンスデータ、全ゲノム、トランスクリプトーム、メタゲノムデータを解析するうえで、DRAGENパイプラインとIllumina Connected Analyticsがどのように役立ったかについてサイエンティストたちが話し合っています。
革新的なゲノム探索へのアクセスを実現
イルミナのベンチトップシーケンスシステムは、世界中のラボにNGSテクノロジーを手軽に利用できる環境を提供しています。これらのシステムが、微生物学研究、がん研究などにおいて、画期的な進歩をもたらすスピード、パワー、柔軟性をどのように実現しているかをご覧ください。MiSeq i100シリーズや、NextSeq 1000およびNextSeq 2000システムは、NGS研究の目標を手の届くものにします。
eBookをダウンロード
主な製品
関連ソリューション
がんエクソーム解析
この手法は、腫瘍進行に関連するコーディング変異に関する有用な情報を提供します。2%未満のゲノムをシーケンスすることで、より高い深度でより経済的にシーケンスできます。がんエクソームシーケンスの詳細はこちら。
希少疾患バリアント解析

NGSベースのエクソーム解析を使用すると、サイエンティストは、希少疾患や未診断疾患に関連するバリアントを明らかにしやすくなります。希少疾患ゲノミクスの詳細
複雑な疾患のゲノミクス
全エクソームシーケンスは、疾患が複雑であるときに原因バリアントを見つけることができる一般的なアプローチです。複雑な疾患研究の詳細はこちら。
RNAエクソームキャプチャーシーケンス

費用対効果、正確で感度の高いRNAエクソーム解析を、たとえ難しい試料であっても、融合遺伝子の検出力を損なうことなく達成します。RNAエクソームキャプチャーシーケンスの詳細はこちら。
NGS企業の選択

使いやすいバイオインフォマティクスツール、信頼されるサポートとサービスを提供する、クラス最高の次世代シーケンサー会社を探してください。エビデンスを見る
ゲノム解析技術に関する最新のニュース、ケーススタディ、情報をお届けいたします。電子メールアドレスをご入力の上、ご登録ください。
補足資料

NextSeq 2000システムにより、NGSはこれまで以上に身近なものになりました。
Dr. Irina Iordanescuが、小児の遺伝性疾患や腫瘍学における全エクソームやターゲットシーケンスパネルなどのアッセイをNGSがどのように強化したかについて説明します。同医師がNGSを使用して、どのようにしてコストを削減しながら、サンプル処理の高速化と拡張を実現したかをご覧ください。
参考文献
- van Dijk EL, Auger H, Jaszczyszyn Y, Thermes C. Ten years of next-generation sequencing technology. Trends Genet. 2014;30:418-426.
*社内計算データ Illumina, Inc., 2015