まとめ
- αサラセミアは、高相同性(約97%)のHBA1およびHBA2遺伝子の変異によって引き起こされます。
- ここでは、HBA座位の欠失バリアントと非欠失バリアントを精確に検出できる、WGSベースの新しいDRAGEN HBAコーラーをご紹介します。
- DRAGEN HBAコーラーと直交型ロングリードテクノロジー間でコピー数が多い遺伝型の一致率を示します。
- また、多様な祖先を持つ大規模サンプルコホートにもDRAGEN HBAコーラーを適用しました。コーラーは、大多数のサンプルのコピー数による遺伝型をコールし、メンデルの法則への高い整合性があるトリオを同定することができます。
- この集団スクリーニング解析では、アフリカおよび南アジアの超母集団にαサラセミアのキャリア頻度が高く、シス位の2コピーの欠失は中国ダイ族の集団で最も高い頻度を示していました。このことは、過去に得られた結果と一貫しています。
- このツールにより、WGSを活用した大規模集団ゲノミクス研究は、HBA座位におけるバリアントの分布を調査し、キャリアおよび新生児スクリーニング検査の最適な実施方法についての判断を導き出すことができます。
αサラセミアは、HBA1およびHBA2遺伝子の変異によって引き起こされる
ヒトでは、αヘモグロビンをコードする2つの遺伝子、HBA1とHBA2は16番染色体に連続して位置しています。つまり、ほとんどの人はα-ヘモグロビン鎖を産生する合計4つの遺伝子コピーを有しています(図1)。HBA1またはHBA2遺伝子のいずれかに2つ以上の変異コピーを継承すると、常染色体潜性の血液疾患であるαサラセミアを発症します。重要なのは、これらの4つのコピーのうち1つ以上の欠失が、世界の一部の地域で非常によく見られることです。これは、マラリア原虫の影響を受けにくいヘテロ接合性キャリアによって進化が促進されたと考えられています7。
キャリアの頻度が高いため、生殖キャリアと新生児を対象としたαサラセミアのスクリーニングが推奨される
HBA1またはHBA2の欠失が頻繁に発生するため、αサラセミアは世界で最も一般的にみられるヒト単一遺伝子疾患の一つとなっています。世界中で300,000人を超える重症患者が影響を受けています9。これは、世界の人口の4%以上がHBA1またはHBA2の病原性バリアントのキャリアであることを意味します10。アフリカのサハラ以南や南アジアなどの特定の地域では、キャリア頻度が30%を超える可能性があります10。キャリア頻度が高く、関連する臨床的影響の深刻度が高いため、American College of Medical Genetics and Genomics6(ティア3リスト)およびAmerican College of Obstetricians and Gynecologists4は、妊娠中または妊娠を計画しているすべての女性を対象に、αサラセミアの母集団全体のキャリアスクリーニングの実施が推奨されています。α-サラセミアの新生児スクリーニングは、米国疾病予防管理センターでも推奨されています2。α-サラセミアの有病率には大きなばらつきがあり、さまざまな亜集団における表現型の原因となるバリアントの分布が不均一であることを考慮すると、この疾患に対する新生児およびキャリアのスクリーニング検査の実施を先導するには、病原性HBA1およびHBA2バリアントの集団特異的分布を完全に理解することが重要です。
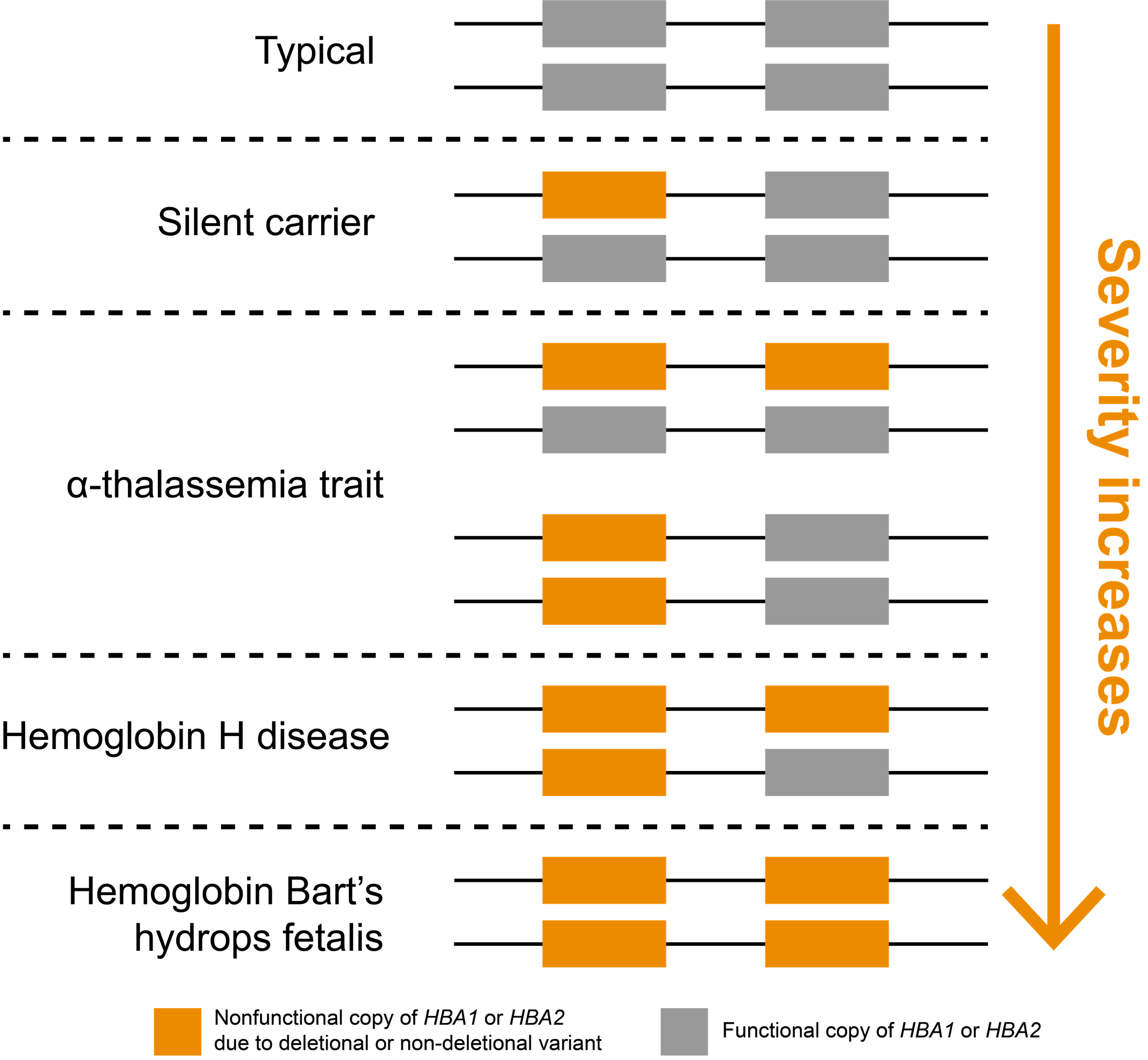
αサラセミアの重症度は、HBA1およびHBA2遺伝子の非機能性コピー数と正の相関がある
非キャリアは、HBA1とHBA2のそれぞれに2つずつ、合計4つの機能性α-グロビン遺伝子を有しています。罹患した個人に認められる症状の重症度は、非機能性コピー数と相関しています(図1)。全遺伝子欠失(「欠失性」)は、これらの遺伝子に最もよく見られる機能喪失型バリアントですが、その他のタイプのバリアントも病原性である可能性があります(「非欠失性」)。HBA1またはHBA2のいずれかの非機能性コピーを1つ保有する人、すなわち3つの機能コピーを持つ個人は通常無症状であり、「サイレントキャリア」と呼ばれます。2つの非機能性コピーを保有する人は、αサラセミア形質(または「αサラセミアマイナー」)を有しています。これらの人々は、軽度貧血などの非重度の症状を有する可能性のあるキャリアです。2つの非機能性コピー(シス位またはトランス位)の構成は症状に影響を与えませんが、生殖に影響を与える可能性があります。
HBA1またはHBA2の3つの非機能性コピーは、ヘモグロビンH(HbH)疾患に関連しており、根底にあるバリアントタイプに応じて、中等度から重度の貧血を引き起こす可能性があります。HBA1とHBA2遺伝子の4つのコピーのすべてが非機能性である場合、その人は「αサラセミアメジャー」であり、最も重症型である「ヘモグロビンBart胎児水腫症候群」として知られるαサラセミアを発症します。この疾患患者のほとんどは出生前または出生直後に死亡します。また、母親の合併症(妊娠高血圧腎症など)のリスク増加につながる可能性もあります。
HBA座位に対する新しいWGSベースのバリアントコール法
従来、α-サラセミアの分子検査は、PCRで濃縮されたα-グロビン遺伝子断片上でサンガーシーケンスまたはマルチプレックスライゲーション依存性プローブ増幅法を使用して行われます。最近では、ターゲットNGSテクノロジーが高感度のαサラセミアのスクリーニングおよび確認方法として実証されています8。これらの濃縮ベースのアッセイは、WGSベースのアッセイと比較して余分な労力と長い調製時間を必要とします。
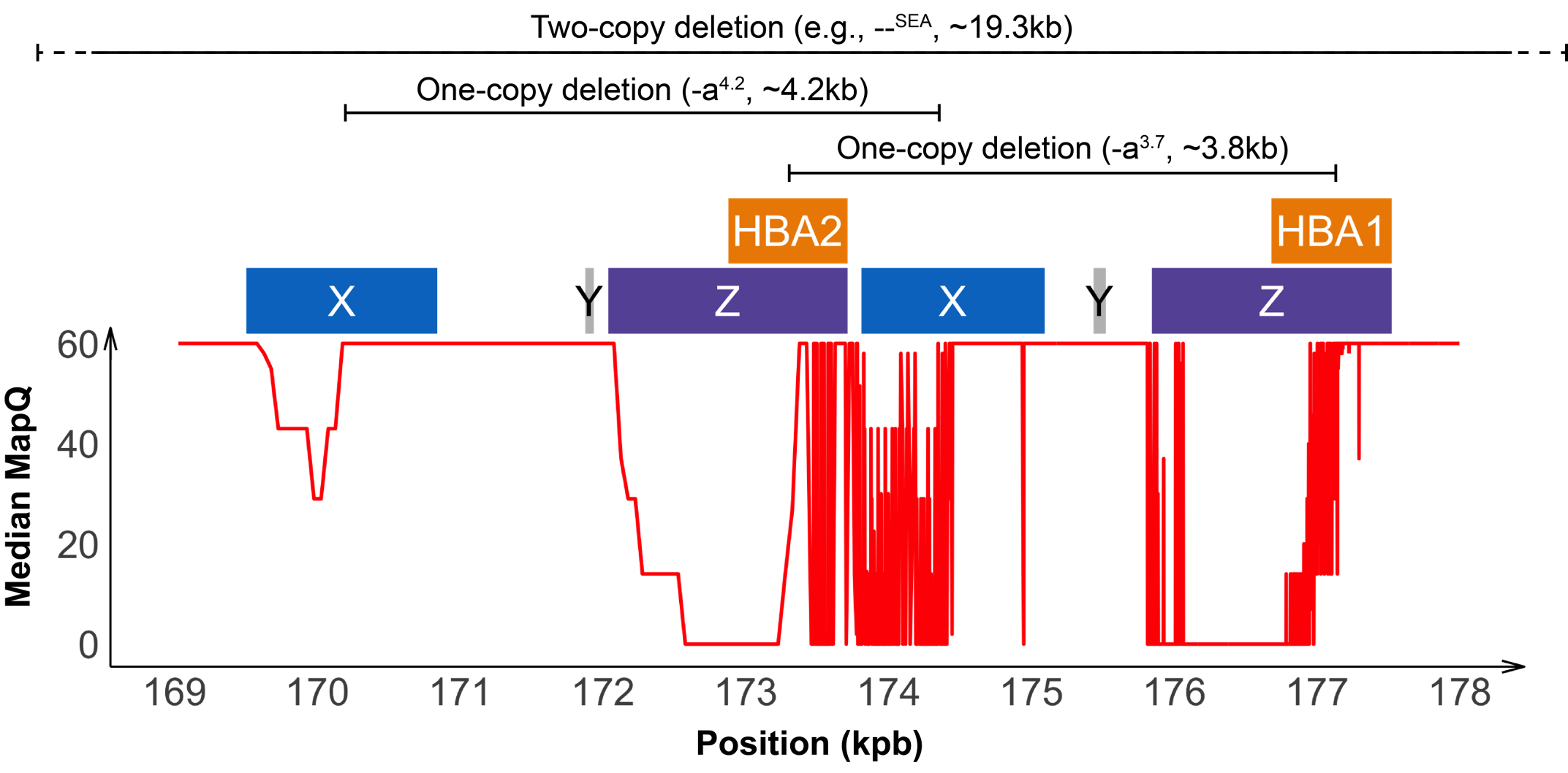
HBA座位のバリアントの検出は、HBA1遺伝子とHBA2遺伝子とその近傍領域間に高い相同性(約97%)があるため難易度が高くなり、リードアライメントがあいまいになります(図2)。重複したHBA1およびHBA2遺伝子は、2つの相同性の高い4 Kb単位内にあり、それぞれがαサラセミアの一般的な欠失型に関与する3つの「相同ボックス」(図2)で構成されています。ZボックスとXボックスの誤対合は、減数分裂時に不均等な相同組み換えにつながる可能性があり、αサラセミアに関連する最も一般的な欠失バリアントである-α3.7(約3.8 kb)および-α4.2(約4.2 kb)の欠失をそれぞれ引き起こします。その他の一般的な欠失バリアントには、1本の染色体中のHBA1とHBA2遺伝子の両方を除去するシス位にある2つのコピーの欠失が含まれます。2つのコピー欠失の最も一般的な形態は、東南アジアの集団に蔓延するSEA欠失です5。全体として、HBA座位の相同性の高い領域は、この座位内に存在するバリアントの同定を困難にするため、専用のインフォマティクスソリューションを必要とします。
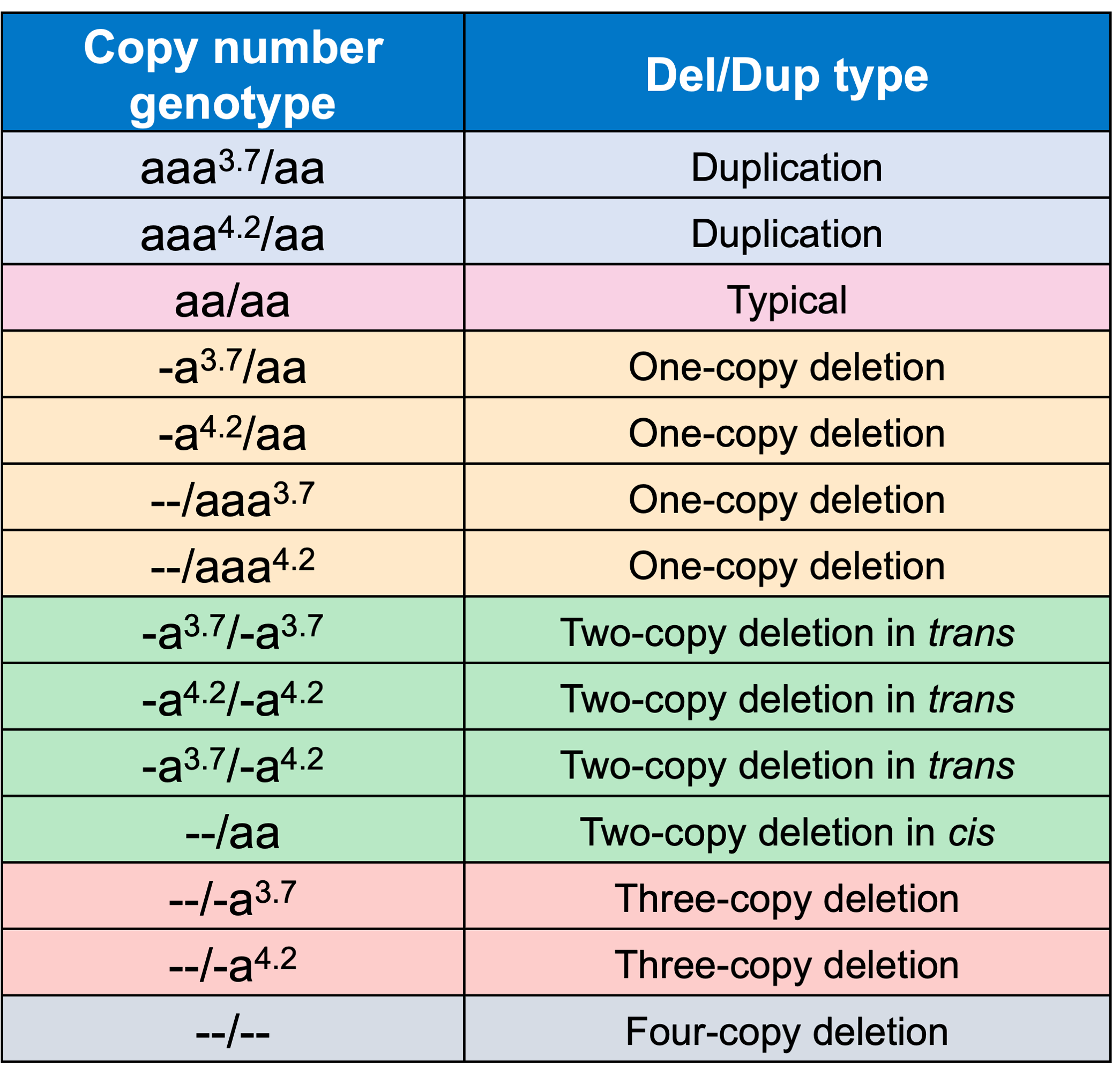
α-サラセミア症例の約95%は、非欠失バリアントではなく遺伝子欠失によるものです11。しかし、非欠失バリアントは、より重度の表現型をもたらすことが報告されています12。DRAGEN HBAコーラーは、複数のラボで病原性または病原性の可能性があるとしてClinVarに報告されている17の小規模バリアントもカバーしています3。このWGSを介したHBA1およびHBA2バリアントをコールする能力により、集団シーケンスの取り組みとαサラセミアの研究プロジェクトが可能になり、この重要な座位に関する洞察を得ることができるのです。
DRAGEN HBAコーラーと直交型ロングリードテクノロジー間のコピー数遺伝型に高い一致率
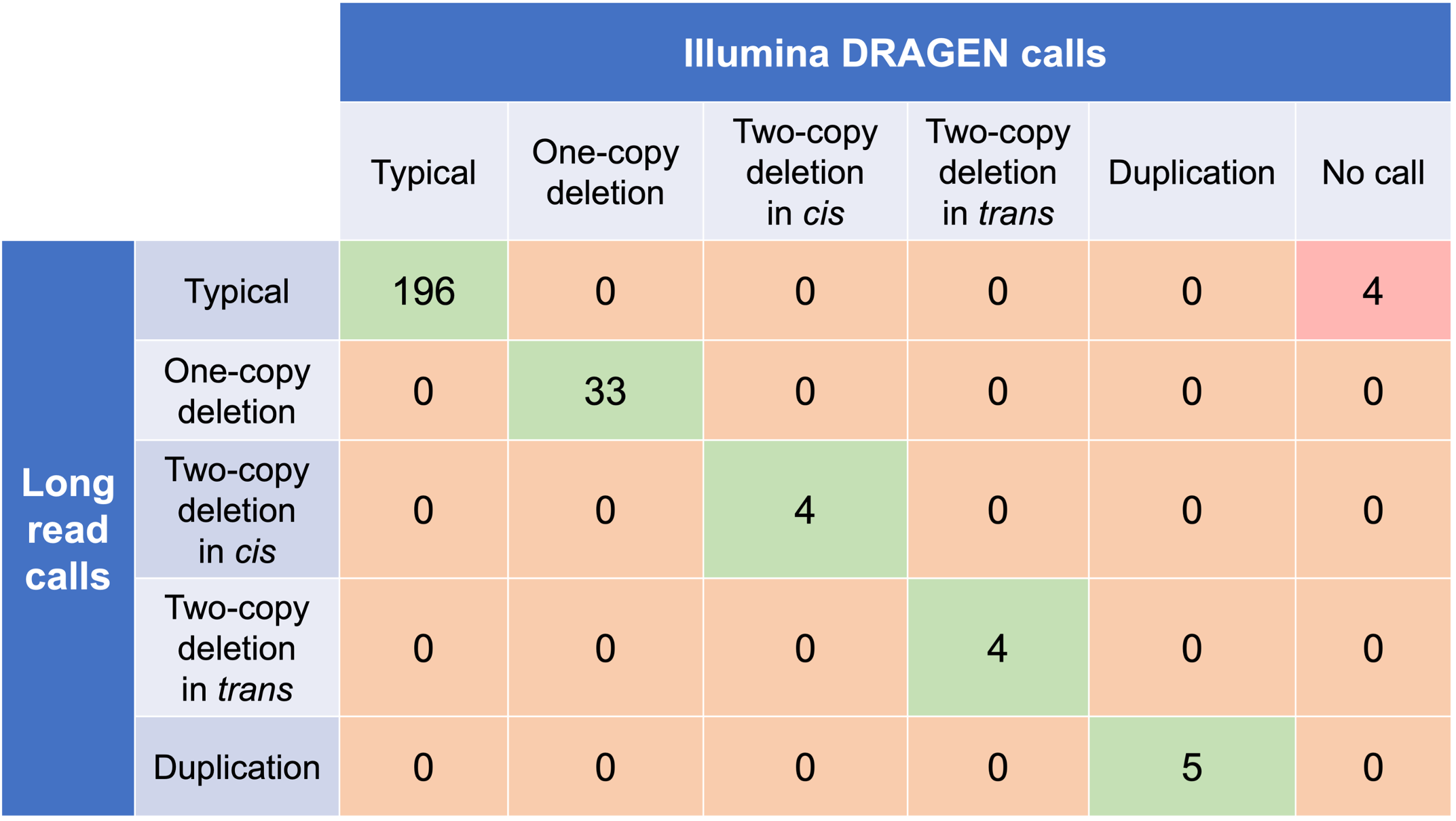
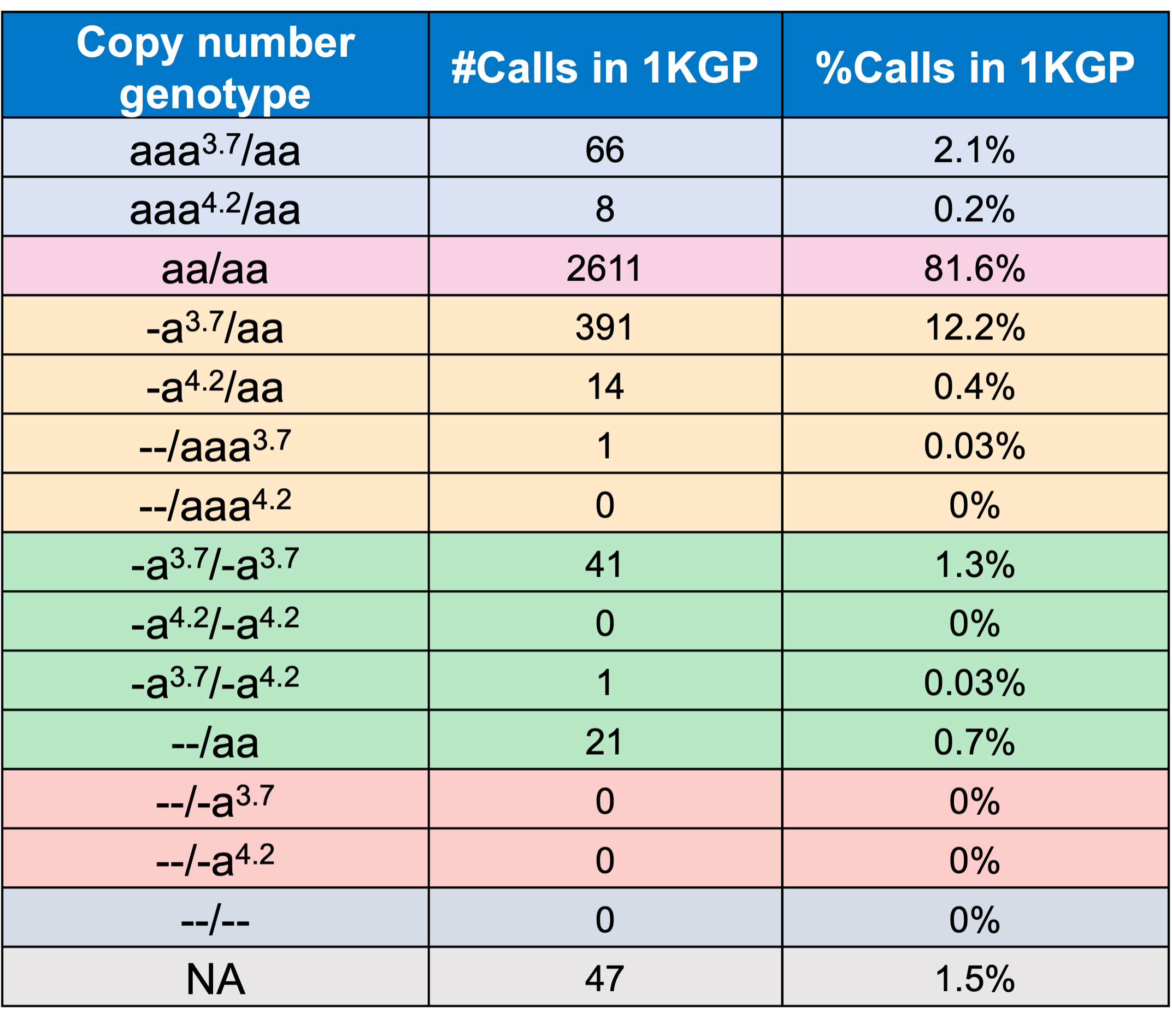
DRAGEN HBAコーラーを評価するため、まずはコーラーと直交ロングリードテクノロジー(PacBio HiFi)のコピー数遺伝型とを比較しました。ロングリードデータからのコピー数遺伝型は、アライメントのパイルアップ形式、フェーズ化したアセンブル、およびSVコールに基づいて作成されました。1000 Genomes Project(1KGP)からの多様な遺伝的背景を持つ246のサンプルと、これにマッチするショートリードとロングリードのシーケンスデータを使用して、DRAGEN HBAコーラーは、すべての主要コピー数遺伝型について直交ロングリードテクノロジーとの高い一致率を実証しました(表2)。DRAGEN HBAコーラーからのノーコール率は1.6%(4/246)でした。今後の取り組みには、4つのノーコール事例の原因の評価を取り入れることができます。
DRAGEN HBAコーラーがメンデルの法則へのトリオの高い整合性を実証
次に、1KGPから取得したトリオデータセットに、DRAGEN HBAコーラーからのコピー数ジェノタイプコールのメンデル式伝達を評価しました。この検査は、メンデルの遺伝法則に基づき、個人のコピー数遺伝型が生物学的両親から受け継がれた可能性があるかどうかを確認します。1KGPから得たコピー数ジェノタイプコールがある575のトリオでは、トリオのコールの100%がメンデル式伝達と整合していました。この結果は、DRAGEN HBAコーラーが血統全体で一貫した遺伝型を達成することを示唆していますが、ジェノタイプコールされたコピー数の精度を保証するものではありません。トリオのメンデル式伝達検査と直交テクノロジーによるコピー数遺伝型一致度検査とを組み合わせることで、DRAGEN HBAコーラーで生成されたコピー数遺伝型の全体的精度と信頼度に自信が持てるようになります。
DRAGEN HBAコーラーは、過去の研究結果と一貫性を示す集団レベルの遺伝型を発見しました
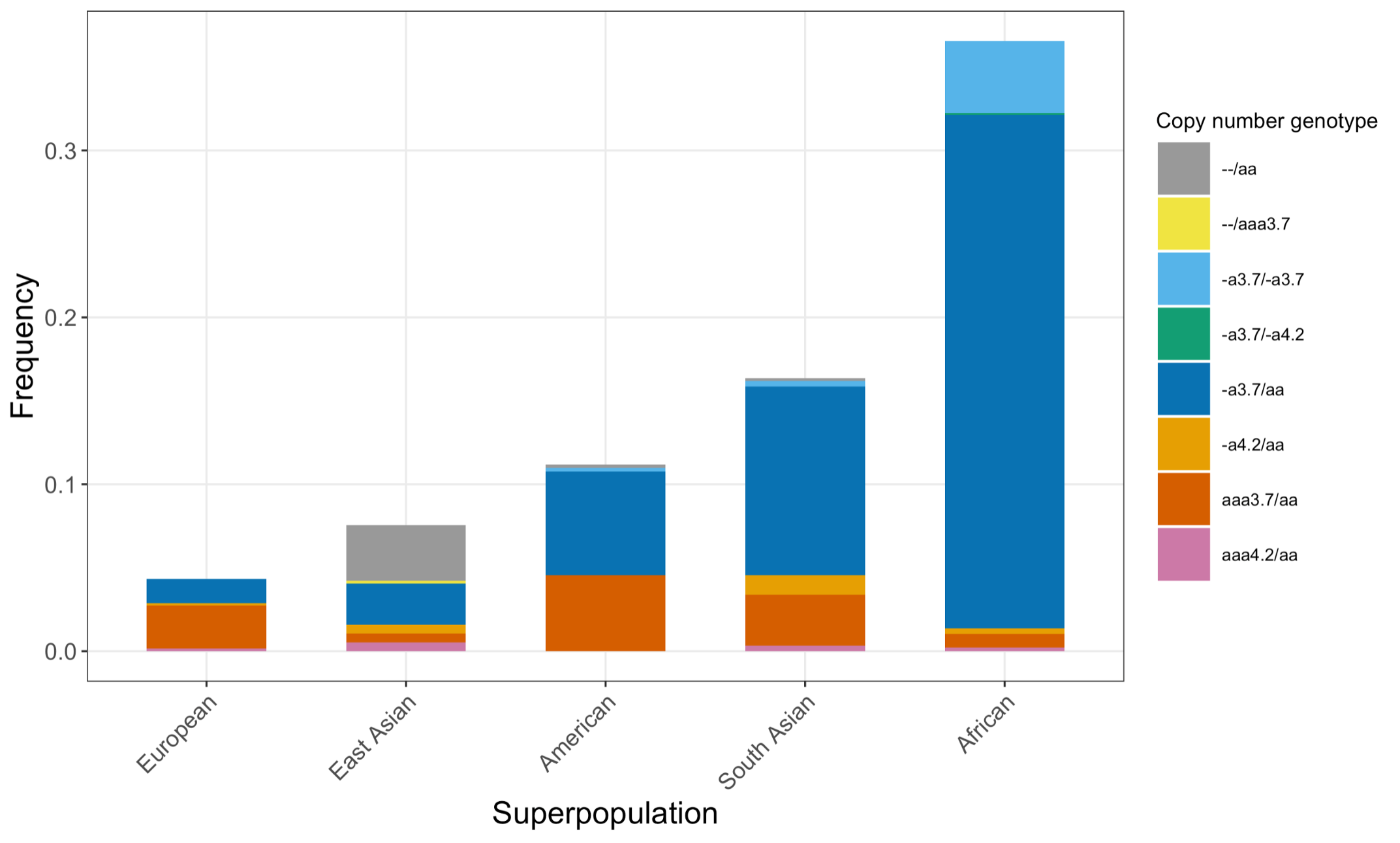
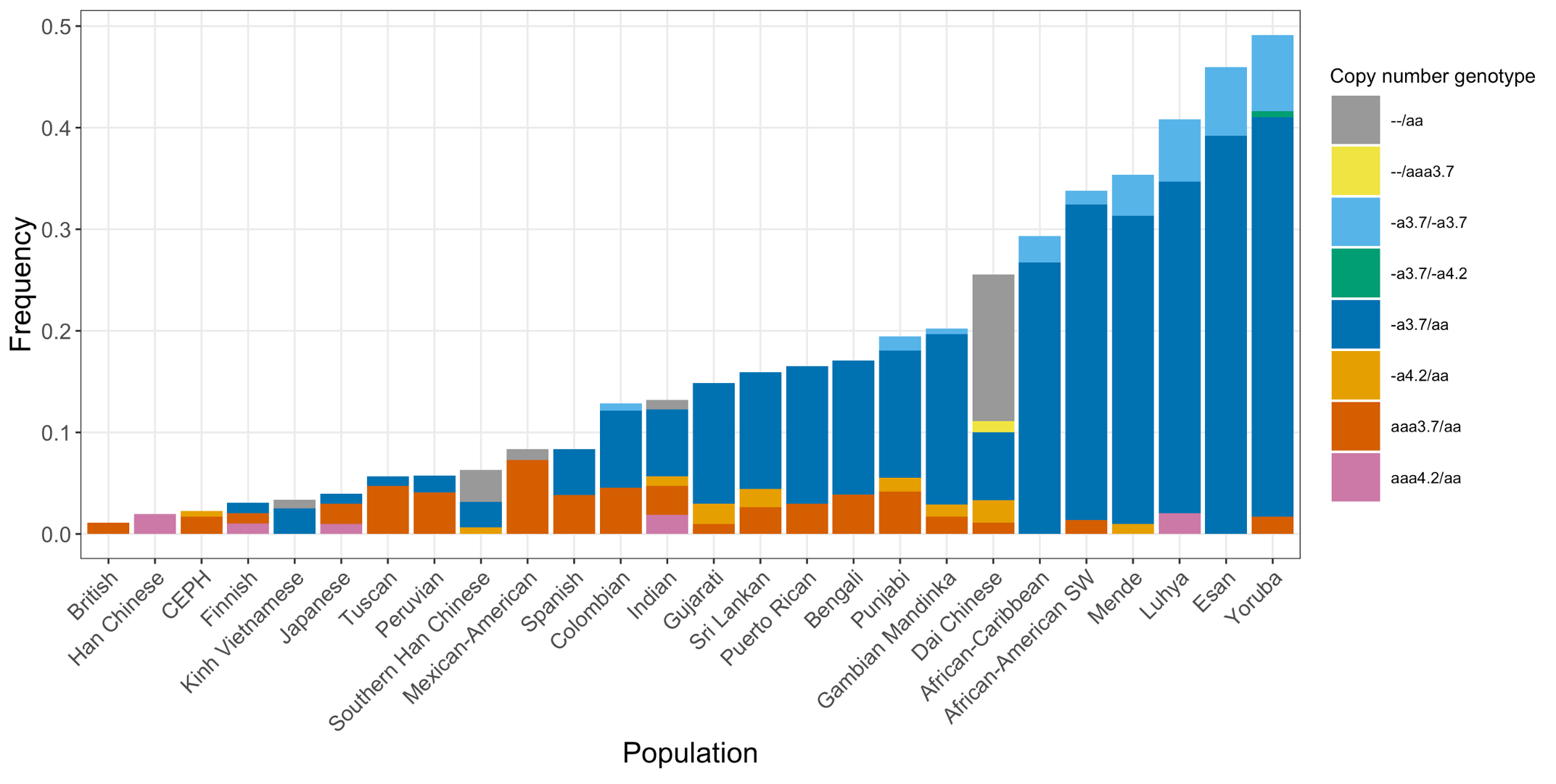
最後に、DRAGEN HBAコーラーを、1KGPから得た多様な遺伝的背景を持つ3201サンプルからなる拡張データセットに適用しました。DRAGEN HBAコーラーは、98.5%のサンプルについてコピー数遺伝型をコールすることができ(表3)、前述の小さなデータセットで観察されたノーコール率の低さが確認されました。アフリカおよび南アジアの集団におけるキャリア頻度は、それぞれ約36%(313/881)および13%(77/593)であり(図3)、シス位の2コピーの欠失は、中国ダイ族の集団で最も高い頻度を示していました(約14%、13/90)(図4)。これは過去に得られた結果と一貫しています8。さらに、DRAGEN HBAのコール元は、1KGPデータセットに1つの病原性がある/病原性の可能性がある小規模バリアントを持つサンプルを5つ検出しました(表4)。このデータセットから発見された小規模バリアントの低発生頻度は、過去に得られた結果とも一貫しています11。

ご利用について
HBAコーラーは、DRAGEN 4.2の発売開始時からご利用いただけます。DRAGEN HBAコーラーへのアクセスをリクエストするには、ffg-info@illumina.comまでお問い合わせください。
学術用途向けの詳細情報またはDRAGEN試用版ライセンスについては、dragen-info@illumina.comまでお問い合わせください。
謝辞
IlluminaのMitch Bekritsky氏、Severine Catreux氏、James Han氏、Carri-Lyn Mead氏、およびSam Strom氏に、この記事に関するコメントを提供していただいたことに感謝いたします。
2022年12月14日:この記事は、DRAGEN HBAコーラーの評価に使用された直交データセットの改訂を反映するために更新されました。改訂されたデータセットは、いくつかのエラー補正が行われ、DRAGEN HBAコーラーとPacBio HiFiリード間の2つの不一致例が解消されました。
注釈
1. Achour, Ahlem, Tamara T. Koopmann, Frank Baas, and Cornelis L. Harteveld. “The Evolving Role of Next-Generation Sequencing in Screening and Diagnosis of Hemoglobinopathies.” Frontiers in Physiology 12 (July 27, 2021): 686689. https://doi.org/10.3389/fphys.2021.686689.
2. Bender, M. A. “Newborn Screening Practices and Alpha-Thalassemia Detection — United States, 2016.” MMWR. Morbidity and Mortality Weekly Report 69 (2020). https://doi.org/10.15585/mmwr.mm6936a7.
3. ClinVar Variation ID: 280127, 375746, 15624, 15627, 15647, 15652, 15656, 15662, 15687, 15690, 15849, 375749, 439126, 439112, 618674, 801169, and 811900 (https://www.ncbi.nlm.nih.gov/clinvar/)
4. “Carrier Screening for Genetic Conditions | ACOG.” 2022年8月1日にアクセス。https://www.acog.org/clinical/clinical-guidance/committee-opinion/articles/2017/03/carrier-screening-for-genetic-conditions.
5. Fucharoen, S., and P. Winichagoon. “Thalassemia in SouthEast Asia: Problems and Strategy for Prevention and Control.” The Southeast Asian Journal of Tropical Medicine and Public Health 23, no. 4 (December 1992): 647–55.
6. Gregg, Anthony R., Mahmoud Aarabi, Susan Klugman, Natalia T. Leach, Michael T. Bashford, Tamar Goldwaser, Emily Chen, et al. “Screening for Autosomal Recessive and X-Linked Conditions during Pregnancy and Preconception: A Practice Resource of the American College of Medical Genetics and Genomics (ACMG).” Genetics in Medicine 23, no. 10 (October 1, 2021): 1793–1806. https://doi.org/10.1038/s41436-021-01203-z.
7. Harteveld, Cornelis L, and Douglas R Higgs. “α-Thalassaemia.” Orphanet Journal of Rare Diseases 5 (May 28, 2010): 13. https://doi.org/10.1186/1750-1172-5-13.
8. He, Jing, Wenhui Song, Jinlong Yang, Sen Lu, Yuan Yuan, Junfu Guo, Jie Zhang, et al. “Next-Generation Sequencing Improves Thalassemia Carrier Screening among Premarital Adults in a High Prevalence Population: The Dai Nationality, China.” Genetics in Medicine 19, no. 9 (September 1, 2017): 1022–31. https://doi.org/10.1038/gim.2016.218.
9. Higgs, Douglas R. “The Molecular Basis of α-Thalassemia.” Cold Spring Harbor Perspectives in Medicine 3, no. 1 (January 2013): a011718. https://doi.org/10.1101/cshperspect.a011718.
10. Piel, Frédéric B., and David J. Weatherall. “The α-Thalassemias.” Review-article. http://dx.doi.org/10.1056/NEJMra1404415. Massachusetts Medical Society, November 12, 2014. World. https://doi.org/10.1056/NEJMra1404415.
11. Pornprasert, Sakorn, Nur-afsan Salaeh, Monthathip Tookjai, Manoo Punyamung, Panida Pongpunyayuen, and Kallayanee Treesuwan. “Hematological Analysis in Thai Samples With Deletional and Nondeletional HbH Diseases.” Laboratory Medicine 49, no. 2 (March 21, 2018): 154–59. https://doi.org/10.1093/labmed/lmx068.
12. Sabath, Daniel E. “Molecular Diagnosis of Thalassemias and Hemoglobinopathies: An ACLPS Critical Review.” American Journal of Clinical Pathology 148, no. 1 (July 1, 2017): 6–15. https://doi.org/10.1093/ajcp/aqx047.