Ca2+イメージングと1細胞RNA-Seqを組み合わせ、 ホヤの運動神経節のCa2+振動細胞を解析。Ca2+と神経回路発生の関係を探る
2017年、慶應義塾大学 理工学部 生命情報学科 准教授の堀田耕司先生らは、無脊椎動物のホヤの発生にCa2+が大きく関わっていることを明らかにし、初期尾芽胚期に現れる、Ca2+濃度が周期的に上昇する細胞を発見しました。そして、1細胞RNA-Seqで分子的なメカニズムの解明にも取り組まれています。発生や進化の謎に挑戦する堀田先生に1細胞RNA-Seqにおける工夫や最新の研究成果について伺いました。
Q. なぜホヤを対象に研究なさっているのでしょうか。ホヤの生物学的な特徴を教えてください。
A. 脊椎動物に最も近く、細胞系譜もあり、発生も速いため、研究がしやすいのです。
ホヤといえば居酒屋で出てくる貝みたいなものだと思われがちですが、進化的には脊椎動物に最も近縁な生き物という位置づけです。ホヤを調べることで脊椎動物の成り立ちを知る手掛かりになります。また、体の構造が単純で、すでに細胞系譜があり、どの細胞が将来どの器官になるかかが早い段階でわかるので、発生という現象を探る上で、複雑な脊椎動物の体よりはシンプルに調べられます。モザイク発生するので、個体差もほとんど考慮する必要がありません。
ホヤの受精卵は18 ℃程度の水温であれば、18時間ほどでオタマジャクシのような幼生になります。このように短い時間で観察できるというのもいい点ですね。
研究に使っているのは、カタユウレイボヤ(Ciona intestinalis type A)で、2002年にゲノム配列が決定されています。
Q. カルシウムイオン(Ca2+)のイメージングによって発見された現象はどんなものだったのでしょうか。また、なぜCa2+に着目されたのでしょう。
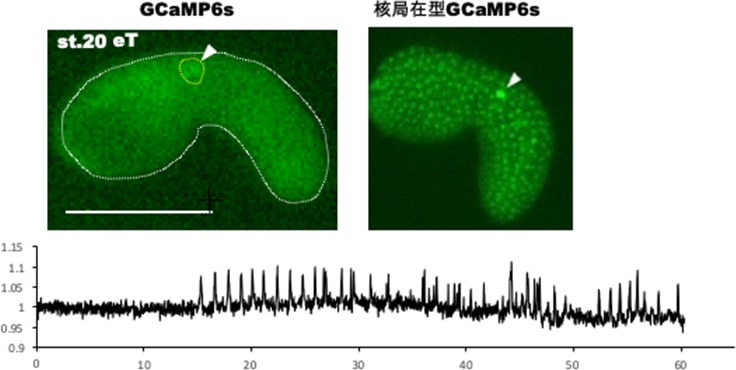
A. 尾芽胚期の1600細胞のうち1対(2個)の細胞でCa2+濃度上昇が70秒周期で繰り返し起こっていました。
当初、細胞分裂の際に、細胞の硬さの変化のような物理的変化を生み出す要因の一つが、Ca2+の濃度変化ではないかと考えて、実験を進めました。アフリカツメガエルの卵割では分裂溝でCa2+が上昇するという1997年の論文があり、ホヤでも初期胚での細胞分裂でアクチンやミオシンといった構造タンパクが硬さの変化を起こすときに、Ca2+の濃度上昇が見られるのではないかと予想を立てました。ところが、ホヤにCa2+センサーGCaMP6sをインジェクションしても、Ca2+センサー自体の翻訳が遅く、タンパク質として成熟したときには細胞分裂がだいぶ進んでしまっていて、初期卵割の時期には見えませんでした。
一緒に実験していた卒研生の赤星太一君と顕微鏡の前で「どうも出ないね」と話していたら、受精から6~7時間後、神経胚時期に胚が一瞬ピカッと光りました。「今光った、光った」と二人で盛り上がりました。初期胚で見られなかったという落胆の後だったので、よけいに感動しましたね。2017年のことです。
それで、原腸陥入以降のCa2+イメージングを行いました。Ca2+センサーを入れると、首の付け根(脊髄の部分)がピカッと光って、その後、筋肉細胞も脊索も神経細胞も表皮も電飾のように光り出します。発生中にいろいろな組織がCa2+シグナルを使っていたのです。核局在型にするともっと鮮明に見えます。何秒間光っているかや何回振動するかが組織ごとに違う。それを網羅的に整理したのが最初の論文*1です。
中でも面白いのが、Ca2+の濃度上昇が繰り返し起こる(振動する)細胞が見つかったことです。尾芽胚期の1600細胞のうち、わずか左右1対(2個)が70秒周期で振動していました。
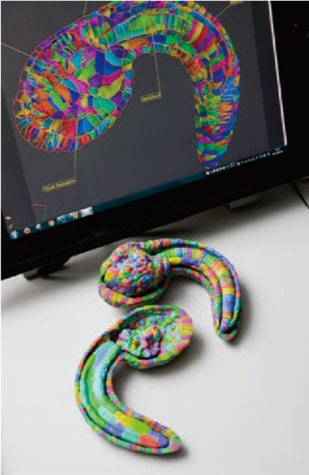
私は解剖学が専門で、尾芽胚期の細胞の種類とその位置を示す3Dマップを研究室で作りました。ホヤの尾芽胚期を共焦点顕微鏡で3D撮影し、当時大学院生だった中村允君が90日かけて、1個体の全細胞の輪郭を抽出し、すべての細胞が将来どの器官になるかラベルしたのです。中村君は「もう二度とやりたくない」って言っていました(笑)。その結果、尾芽胚を構成する主要組織は8組織あって、中枢神経230個、表皮836個、内胚葉199個の細胞があること、また、変態して成体になるときの幹細胞の位置などを明らかにし、“Developmental Biology”の表紙を飾りました*2。
この研究がベースにあったので、尾芽胚期に首根っこにある、とりわけ大きくて神経管の側方に飛び出ている特徴的な細胞の形をこの3Dマップに照らし合わせると、この細胞は運動神経の最も後方にあり、5 対ある運動神経細胞(Horie et al., 2010)のいずれかで、遊泳の際に尻尾を振る運動に関わることが予想できました。そして、この細胞が光った後にその指令が筋肉細胞に伝わり、同期発火することもわかったのです(赤星ら、日本分子生物学会2019)。
ホヤの神経系もヒトの神経系も脊髄に振動を生み出す運動神経回路があると言われており、運動神経につながって筋肉を動かす点は同じですし、進化的にも幼生が尻尾を振る運動が歩行運動に進化してきたと考えられるので、この振動を生み出す分子的なメカニズムを調べて、同じようなホモログをヒトやほかの動物で探せたら、脊椎動物の運動神経回路を知ることができるかもしれません。
Q. シングルセルのRNA発現解析をされた理由、試薬やキットを初めて使ってみた印象をお聞かせください。
A. 新規分子機構の探索には1細胞RNA-Seqが最適と考え、自分で挑戦しました。生物種を超えて使える方法だと思います。
受精時に見られるCa2+振動の発生機構では、IP3 受容体を介したCa2+遊離が必須で、IP3 受容体を用いたCa2+振動モデルが提唱されています。一方、このCa2+振動のメカニズムは未知であるため、調べるにはどうアプローチしたらいいのか悩みました。
マイクロアレイやRT-PCR法、ホールマウントin situハイブリダイゼーション法などのターゲットを絞ったアプローチでは、ターゲットの外に候補があった場合は釣れてこないので、今回のような新規の分子機構の可能性がある場合、1細胞由来の転写物を網羅的にその場で同定できる1細胞RNA-Seq(scRNA-Seq)がいいという判断です。サンプルもそんなに簡単に作れないし、動的な現象であるということもありました。
一番苦労したのは、Ca2+振動細胞の単離です。GCaMP6 mRNAを導入した初期尾芽胚の1600個の細胞をまずバラバラにします。昔からホヤで使われているのは、コリオン剥き液という、チオグリコール酸とアクチナーゼEの混合物、さらにはトリプシンなどの酵素で、それらをいくつか試したところ、トリプシン処理とピペッティングの両方を組み合わせるのが一番うまくいきました。かなり強くピペットで何回も吸ったり吐いたりしていくうちに、細胞は意外にコロッと取れて、傷がつかなかったですね。ホヤの幼生にはセルロースでできた強固な被嚢ができるため、早い時期にバラバラにしたほうがいいということはわかりました。
この後、セルソーター(FACS)で細胞を選別できればよいのですが、セルソーターは蛍光輝度をもとに細胞を選別する一方で、私のみつけた振動細胞のGCaMP6の蛍光は振動するので選別は不可能です。良いマーカーがないので、セルソーターは使えません。そこで、このバラバラになった細胞をシャーレに入れ、蛍光顕微鏡の視野に収まるように真ん中に寄せて、3DのCCD カメラで10分間ほど撮り続け、そして、画像を再生して、Ca2+動態を計測しました。一過性に光っているのか、同じ場所で振動しているのか、グラフを描きながら、振動している細胞を探し、位置を記録し、シャーレを揺らさないように実体顕微鏡下に移します。解析を早くしないと、発生が進んでしまうので、2~3時間以内ですね。そして、ピペットでそれを吸います。数μくらいしか離れていない細胞を吸うのです。普通のピペットでは1細胞を扱うのは難しいので、最終的にガラス管の先端を削り、シリコンチューブにつなげて、自分で特製のものを作りました。
こうして、Ca2+振動細胞を単離して、シャーレの上に置いてみたら、他からのシグナルの入力がなくても自律的にCa2+振動していることがはっきりしました(日本動物学会2019)。
そして、SMART-Seq HT Kit(Takara Bio)を用いてcDNAライブラリを作製しました。普通の動物細胞でも塩濃度が高いとうまくいかないこともあると聞いていましたので、なるべく海水を入れないよう強く吸いすぎないようにしました。また、指示通りにLysis Bufferにすぐに入れることも心がけました。
使える細胞の数が少ない上、1細胞ごとのRNA-Seqがうまくいくのか、最初は半信半疑でした。
1回目の別のキットでは残念ながら検出限界でしたが、2回目のSMART-Seq HT Kitではかなり収率がよく、うまくいきました。SMART-Seq HT Kitはステップ数が減っていたので、使いやすかったですね。
そして、iSeq 100システムにより200万リード分の転写配列の解読に成功しました。得られた配列データを、カタユウレイボヤ遺伝子モデル(KH2012モデル)と照合しました。
5 対の運動神経細胞にはそれぞれ転写因子などが特異的に作用することで分化が進みますし(Imai et al., 2009 Development; Stolfi et al., 2011 Development)、ネガティブコントロールとしてCa2+振動がない神経細胞も調べていますので、Ca2+振動細胞と比較しての違いを見ています。
そして、含まれる転写物がどの運動神経節由来の細胞であるか検証した後、転写物の評価を行いました。
有意に発現差異のあった分子(チャネル遺伝子等)を拾っていき、それを、in-situハイブリダイゼーションして、実際に振動している細胞のみで発現している分子や遺伝子を見つければ、かなり強い手掛かりになると考えています。これから、同定した遺伝子をノックダウンすると振動が起こらなくなるかどうかを調べます。いずれ共同研究で脊椎動物と比較したいですね。
この一連の方法で、セルソーターがなくても、Ca2+以外の動的なセンサーが陽性な細胞や、動き回る細胞など、同じアプローチでRNA-Seqが実現できそうです。1細胞や少量細胞からの遺伝子発現解析自体は、生物種を超えて使える方法なので、こういう実験を専門にやっていない研究者の方もプロトコルを忠実に守りながら実験を行うことで新たな知見が得られる可能性を秘めていると思います。
Q. 今後はどのようなテーマで研究を進められるのでしょうか。
A. Ca2+イメージングとRNA-Seqを組み合わせ、岩などに付着する際の機械感覚受容分子を特定したいですね。
2018年から尾芽胚期以降のCa2+イメージングを行っています。遊泳しているホヤ幼生は岩などに当たった刺激で変態します。岩などに付着すると運動する必要がなくなるので幼生の運動神経の回路や尾部は退化すると同時に成体の組織の分化が始まるという劇的な変化を、変態の間に生み出します。この機械刺激を受けたときに何が起こるかがCa2+イメージングで見えてきました。
今後は、この変態のきっかけとなる機械感覚受容分子を同定したいと思っています。TRPやPIEZOのようなこれまで知られている機械刺激受容分子、あるいは未知の分子が見つかるかもしれません。RNA-Seqで新しい事象が見えてくることを期待しています。
RNA-Seq関連情報
関連論文
1. Characterization of calcium transients during early embryogenesis in ascidians Ciona robusta (Ciona intestinalis type A) and Ciona savignyi
Taichi Akahoshi, Kohji Hotta, Kotaro Oka
Developmental Biology Volume 431, Issue 2, 15 November 2017, Pages 205-214
2. Three-dimensional anatomy of the Ciona intestinalistailbud embryoat single-cell resolution
Mitsuru J. Nakamura, Jun Terai, Reiko Okubo, Kohji Hotta, Kotaro Oka
Developmental Biology 372 (2012) 274–284