ショウジョウバエの発生をシングルセル解析とイメージングを組み合わせて解き明かしたい
京都大学 大学院生命科学研究科 特定助教の近藤武史先生は、大学院時代から、ショウジョウバエを用いて、新規マイクロペプチドや上皮組織の形態形成に関する研究などで大きな成果を挙げてこられました。シングルセル解析を研究手法に加え、さらに深い研究を目指す近藤先生に研究内容と自身が担当される共通機器室の運営について伺います。
Q. 近藤先生の現在のご研究について教えてください。
A. ショウジョウバエの胚発生をモデルとして、動物の形作りの仕組みについて研究しています。
私のグループでは発生の研究、特に動物の形が自律的に構築される仕組みを明らかにすることを目的として、ショウジョウバエ胚をモデル系として研究をしています。発生遺伝学による初期発生の研究が1970~80年代くらいから盛んになりましたが、ショウジョウバエはそのときから発生学の分野でよく用いられている実験系の一つです。1995年には、「初期胚発生の遺伝的制御に関する発見」として、ノーベル生理学・医学賞を受賞しています。古くからの変異体を用いた遺伝学的手法に加えて、ゲノミクスやイメージングなど、さまざまなアプローチによる解析が行われており、最近では、複雑な現象を理解するために数理モデルを用いたシミュレーション解析も進んで来ました。理解が進んでいて、高度な遺伝学的操作も駆使できる実験系なので、wetとdryの両面で、最先端の技術は取り入れやすいと思います。発生制御の基本的な仕組みは動物で共通する点も多いので、ショウジョウバエを用いた研究から、その原理を明らかにしたいと考えています。
Q. 学生時代にはどのようなご研究をなさっていたのですか?
A. ゲノムの非コード領域からマイクロペプチドをコードする新たな遺伝子を同定し、発生制御における役割を明らかにしました。
大学院生のときは、ゲノム科学、特にアノテーションされていないようなノンコーディングRNA(ncRNA)の研究を進める中で、11アミノ酸長という非常に短いORFにマイクロペプチドをコードする遺伝子を新たに同定し、それが発生に重要な役割を果たしているということを明らかにしました。
学部生だった2000〜2003年あたりにヒトのゲノム配列が公開され、ヒトでもタンパク質をコードする遺伝子が予想されていたよりもかなり少ないという話になっていました。そういった背景で生命の設計図としてゲノムの非コード領域の機能に興味を持ち、奈良先端科学技術大学院大学バイオサイエンス研究科に入学後、ncRNAの研究を始められていた影山裕二さん(現・神戸大学准教授)のグループで研究を始めました。
mRNA様長鎖ncRNA(long non-coding RNA, lncRNA)の候補として完全長cDNAライブラリーから非常に短いオープンリーディングフレーム(ORF)しかもたないものをスクリーニングし、解析を進めていました。その過程で、その中の一つでpolish rice(pri)と名付けた遺伝子が、実際は11あるいは32アミノ酸長のマイクロペプチドをポリシストロニックにコードすること、そしてそのマイクロペプチドが正常な胚発生に必須であることを明らかにしました。1 このときに自分が想像していなかった予想外の発見という研究の醍醐味を初めて味わうことができました。
Q. マイクロペプチドをコードするということを、どのように発見されたのでしょうか?
A. 4つのORFが共通の7アミノ酸配列を含んでおり、それが近縁種でもよく保存されていることに気がついたのがきっかけです。
このmRNAに存在する初めの4つのORFが同じ7アミノ酸の配列を含んでいたのと、ショウジョウバエの近縁種のゲノムも公開され、それら近縁種でも7アミノ酸配列が保存されていることが判明し、これらマイクロペプチドが機能を担っているのではないかと予想することができました。その後、実際に翻訳されるかどうかや、ORFに変異を導入した場合の機能の解析などにより、遺伝学的にペプチドが機能性分子であることを明らかにしました。そしてこのマイクロペプチドの機能として、表皮の細胞突起形成に重要な働きを担う転写因子の活性変換に必須であることも明らかにしました。2
Q. 理化学研究所に異動されたのは、発生・制御の研究を深めるためでしょうか?
A. イメージング技術を用いて、組織の形態形成制御に関する研究を行いました。
発生過程は非常にダイナミックな現象です。実際に自分で観察し、その動的な感覚を養いたいと思いました。そのためのイメージング技術を学ぶために、理化学研究所発生・再生科学総合研究センターの林茂生先生の研究室にポスドクとして参加させていただきました。そこではライブイメージング技術を駆使して、特に上皮組織の形態形成制御に関する研究を行ました。変異体や物理的な微小破壊などの実験から、分裂期への進行に伴う細胞の球形化が気管原基の陥入運動を加速し、形作りを適切に進めるため重要であることを示しました。3 このときに、当たり前のことではあるのですが、ある現象の理解を深めるためには対象を可能な限り詳細に観察し、洞察することが非常に大事であることをあらためて学ぶことができました。
Q. 京都大学ではご自身のご研究はどのように発展されていますか?
A. 正確な発生制御のための、ゲノムから細胞、多細胞組織といった異なる階層間の相互作用ルールに注目しています。
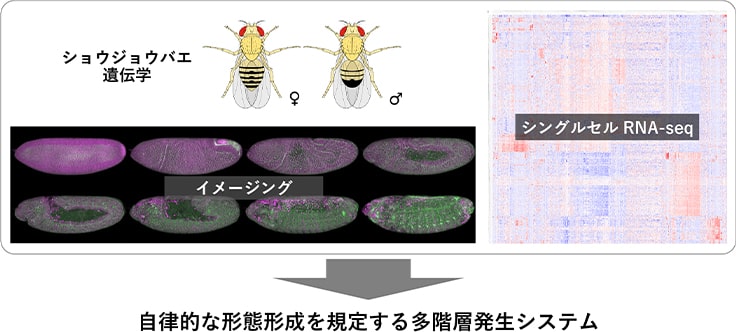
適切な生理機能を発揮する器官を構築するためには、形が出来上がるだけでは不十分です。構成する細胞の生理機能、つまり細胞分化とうまく調和する必要があります。しかし、ダイナミックな発生過程でそれがどのように達成されているのか、まだ謎が多く残されています。そこで京都大学に移ってからは、このような上皮組織の形態形成と細胞分化の関係に注目した研究も進めています。そして、ショウジョウバエ胚の気管形成では、上皮組織変形という物理的な情報に依存した遺伝子発現の調節が、組織形状と細胞分化の正確な調和に重要な役割を担っていることを明らかにしました。4 つまり、生命システムを構成する遺伝子〜細胞〜多細胞組織という異なる階層の間での多様で両方向性な相互作用により、安定して複雑な発生現象が生み出されていると考えています。そのような多階層からなる発生制御システムの全体を俯瞰的に理解するために、現在は1細胞レベルでのRNA-Seqの技術も取り入れて研究を行っています。
Q. イメージングだけでなくシングルセルでRNA-Seq解析が必要と思われた理由は何ですか?
A. ゲノムにコードされる遺伝子がどういう組み合わせで機能し、細胞のふるまい、さらには全体の発生現象を制御しているのかを明らかにしたいのです。
各遺伝子の機能を詳しく知ることももちろん大事ですが、発生現象をひとつのシステムとして理解するためには、やはりそれだけでは足りないと感じています。そのためゲノム、細胞、個体をという異なる階層を俯瞰的に見て、全体として発生がうまく進むのかを知りたい、という気持ちがあります。
例えば、発生過程では胚の各領域が異なる運命を獲得し、それぞれが異なる様式で変形します。各領域の運命を規定するマスター因子についてはよくわかっていて、それらの発現を操作すると組織の変形パターンも変わります。これらマスター因子の多くは転写因子なので、その下流の遺伝子発現制御を介して細胞動態・組織変形をコントロールしていると考えられますが、実際にゲノムワイドな遺伝子発現パターンが細胞ごとにどの程度異なるのか、それが細胞動態の制御にどう関わっているのか、まだまだ理解は進んでいません。
イメージングにより、1つ1つの細胞のダイナミックな動態を観察できます。しかし、一般的な顕微鏡によるイメージングでは、一度に4種類ぐらいの蛍光情報しか得ることができないので、個々の細胞についてもっと多様な情報を取得できないかと常に思っていました。これまでよりもより深く各細胞を観察したい、というシンプルな動機です。そういったなかで自分の研究グループを立ち上げるにあたり、近年その技術が進んできたシングルセルゲノミクス、特にシングルセルRNA シーケンス(scRNA-Seq)を研究に取り入れることを決めました。イメージングによる細胞動態の解析と並行して、scRNA-Seqにより細胞ごとの遺伝子発現情報を取得し、これらをうまくつなぐことで両者の関係性を明らかにする、というのがねらいです。
今は胚から細胞を分離してscRNA-Seqをしていますが、そうすると各scRNA-Seqデータの元の胚空間における位置情報は失われてしまいます。そこで、ショウジョウバエ胚ではさまざまな遺伝子の空間発現パターンがよく分かっていることを活用して、それらをリファレンスとして各scRNA-Seqデータについて元の空間位置を推定することを進めています。現在は、1細胞列単位というレベルで空間位置を推定することができるようにもなってきました。将来的には、遺伝子発現から組織変形、さらには胚全体の形作りを予測できるようなかたちでその制御システムを理解することを目指しています。
Q. 近藤先生は共通機器室の運営も担当していらっしゃいますね。どのような経緯でご担当になられたのでしょうか。
A. こちらに着任したときに所属研究科でNGS関係の業務を担当することになり、その後NextSeqの導入に伴いその共通機器利用を進めてきました。
私自身は若手研究者育成事業の一環である、京阪神次世代グローバル研究リーダー育成コンソーシアム(K-CONNEX)のプログラムで採用していただき、2015年に京都大学大学院生命科学研究科で自身の研究グループを立ち上げる機会をいただきましたが、そのときに所属研究科でのNGS関係の業務も担当することになりました。
当時はまだNGS解析については各ラボで外注するか、共同研究先で解析するかといった状況でした。その後、大学の共通機器としてNextSeqが導入されることになり、私がその管理・運用を担当することになりました。そこで機器を有効に活用するために、解析の受託も含めた共通利用の体制の構築を行ってきました。
2009年から在籍していた理化学研究所 発生・再生科学総合研究センターでは、コアラボのシステムがうまく構築されており、私自身もユーザーとして使わせていただいていました。こちらで共通利用の体制を立ち上げるときには、そのときの経験が役に立ちましたし、実際にいろいろと相談をさせていただくなど、お世話になりました。もちろん研究科内外の多くの方にもご協力いただきながら、受託解析を含む運用ができるようになってきました。
Q. 研究者のみなさんの利用の状況はいかがですか。
A. 生命科学研究科を中心に、医学研究科や薬学研究科、理学研究科、ウイルス・再生医科学研究所などの学内の多くの方にご活用いただいています。
NextSeqが導入されてから3年が経ちますが、年間に50〜75ランのシーケンス解析を行っています。現在では、そのうちほぼ半数は、依頼者の方にRNAかDNAでサンプルを提出してもらい、ライブラリー調製からシーケンス解析を請け負っています。残りは、利用者がご自身で調製されたライブラリーのシーケンス解析として利用いただいています。
生命科学研究科の場合は、マウス、ショウジョウバエ、線虫といった動物から、シロイヌナズナやゼニゴケなどの植物、微生物などモデル生物を対象とした解析がメインで、解析内容としては遺伝子発現解析のためのRNA-Seq、もしくは変異体の変異同定のためのゲノムリシーケンスが多いです。
共通機器として運用しており、学内のすべての方が利用可能です。実際に生命科学研究科だけでなく医学研究科や薬学研究科、理学研究科、ウイルス・再生医科学研究所などの多くの方にご活用いただいています。これはやはり、NGSが分野によらず生物学の多くの領域で必須になっていることのあらわれと思います。
Q. 受託を受ける際にはどのような点を心がけて進められているのでしょうか?
A. 実験計画からデータ解析まで、綿密なコミュニケーションでサポートすることを心がけています。
解析を受けるときには、まずはじめに直接打ち合わせをさせていただき、解析の目的や方針についてお話させていただくようにしています。できるだけ有意義でクオリティの高いデータを取得してほしいという思いからですが、このようにして綿密なコミュニケーションができるのは近くにいるメリットと考えています。私自身はそれぞれの研究者から研究内容を聞くこと自体もとても面白く、いろいろと勉強になっています。シーケンス後はデータのクオリティを確認した上で、シーケンスデータを依頼者にお渡ししていて、その後のデータ解析はできるだけ依頼者自身で進めていただくようにお願いしています。データ解析の経験のないwetの研究者にとって敷居が高いとは思うのですが、今後NGSデータ解析の知識・技術は生物学の研究に携わる限り必須になると思いますし、特に大学院生に対する教育的な効果も考えてのことです。自分の研究データであれば解析に対するモチベーションも高いと思いますし、そのデータの研究背景をよく理解している研究者が解析することで初めて見えてくることもあるとも考えています。また一度壁を乗り越えてしまえば、自身のデータだけでなく公開データも活用して研究することができるようになり、研究の幅は大きく広がると思います。ただし、ただ各自にまかせるだけではうまく行かないと思いますので、NextSeqの導入と同時期に研究科でNGSデータ解析の演習講義も始めており、できるだけその敷居を下げるための取り組みもしています。また、実際に解析で行き詰まったときには、その都度サポートするようにもしています。このように解析前の計画からデータ解析までできるだけ細かにサポートするように心がけていますが、これはやはりお互いが近くにいる大きなメリットだと思います。
現在は、共通機器としての体制をさらに整え、学内だけでなく学外の方にも使っていただけるように準備も進めています。利用者の方のご意見も聞きながら、学内の共通機器としての強みを活かして、多くのすばらしい研究成果につながることを第一に考えて今後も運用していきたいです。
シングルセル RNAシーケンス関連情報
関連論文
1. Small peptide regulators of actin-based cell morphogenesis encoded by a polycistronic mRNA. Kondo, T., Hashimoto, Y., Kato, K., Inagaki, S., Hayashi, S., and Kageyama, Y. Nat. Cell Biol. 9, 660–665 (2007)
2. Small peptides switch the transcriptional activity of Shavenbaby during Drosophila embryogenesis. T. Kondo, S. Plaza, J. Zanet, E. Benrabah, P. Valenti, Y. Hashimoto, S. Kobayashi, F. Payre, Y. Kageyama, Science, 329, 336-339 (2010)
3. Mitotic cell rounding accelerates epithelial invagination. Takefumi Kondo & Shigeo Hayashi, Nature volume 494, pages 125–129 (2013)
4. Two-step regulation of trachealess ensures tight coupling of cell fate with morphogenesis in the Drosophila trachea. Kondo, T., and Hayashi, S. eLife 8, e45145. (2019)
研究グループHP: http://www.dev-system.lif.kyoto-u.ac.jp